Stamcellen veranderd in neuronen kunnen motorische functies herstellen bij ratten. Toekomstmuziek voor Parkinson patiënten?
Stamcellen in het laboratorium werden veranderd in zenuwcellen (neuronen) die dopamine kunnen aanmaken – de chemische stof die ontbreekt bij patiënten met de ziekte van Parkinson. Nadat ze getransplanteerd waren naar de hersenen van ratten met een vorm van parkinsonisme, werkten ze mee om de verloren motorische functies te herstellen, zo bleek uit een studie.
Na de gunstige bevindingen van dit experiment bij ratten zijn onderzoekers van plan binnenkort over te gaan tot een klinische proef met echte patiënten met de ziekte van Parkinson, veroorzaakt door mutaties in het PRKNgen. Dit gen geeft instructies voor het aanmaken van een eiwit dat parkin wordt genoemd. Dergelijke patiënten vertonen de typische motorische symptomen van idiopathische (veroorzaakt door een onbekende oorzaak) Parkinson, maar hebben geen andere symptomen zoals cognitieve achteruitgang of dementie. Hierdoor zijn ze ideale kandidaten voor het testen van de stamcellen.
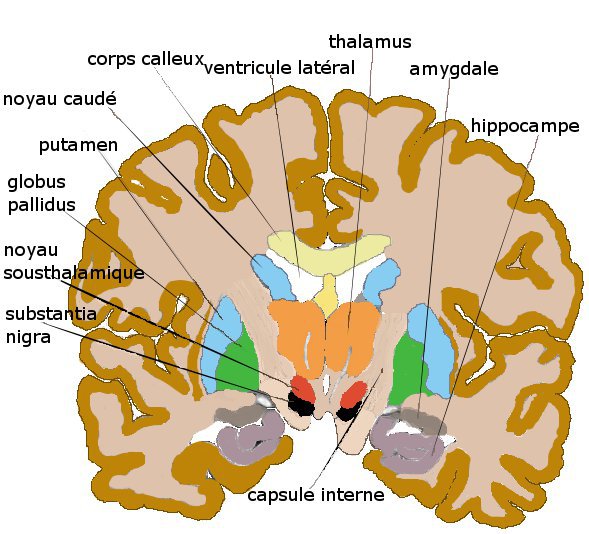
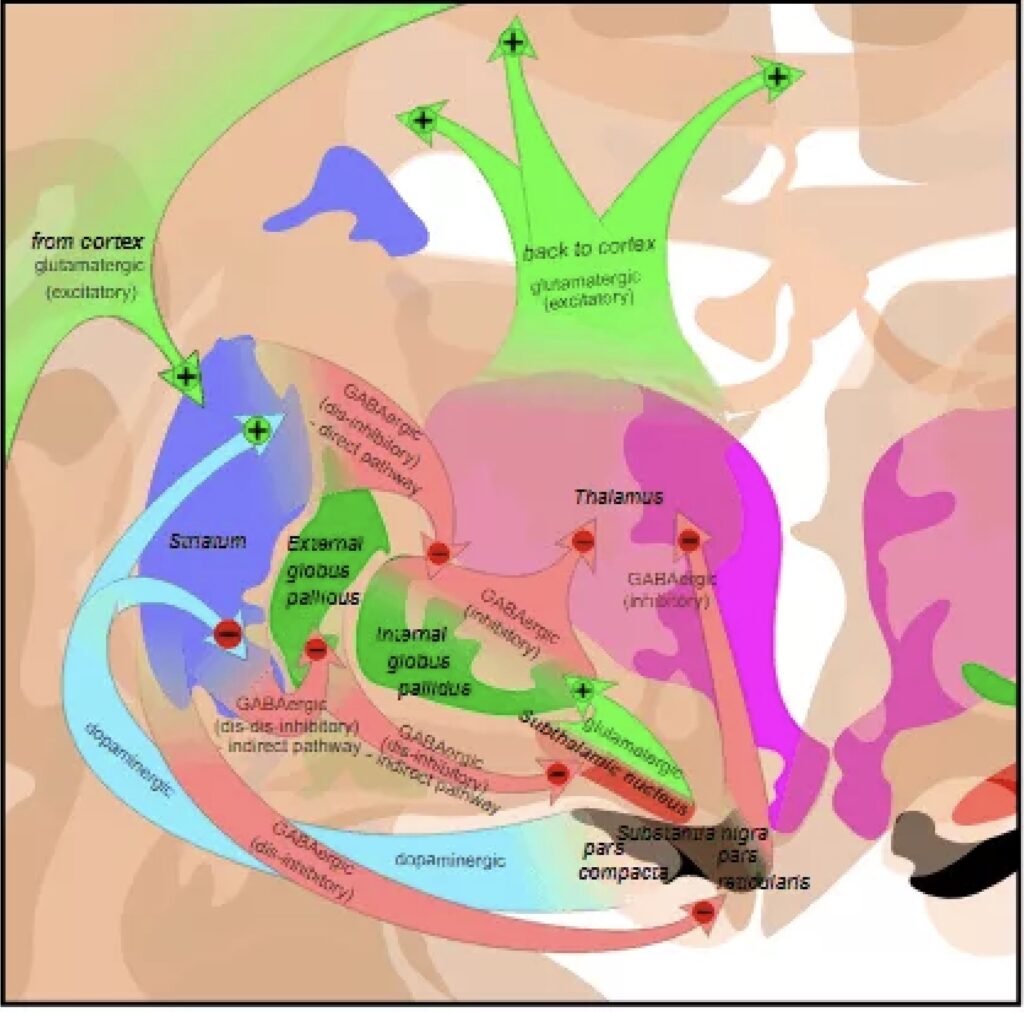
Fig.1: De substantia Nigra is een klein gebied in de middehersenen, dat wordt gekenmerkt door zwarte (zwart =nigra) dopamine producerende cellen. Bij de ziekte van Parkinson sterven deze cellen af en dit veroorzaakt de motorische stoornissen.
Als de getransplanteerde stamcellen effectief blijken te zijn, zal het onderzoek worden uitgebreid door een groter klinisch onderzoek uit te voeren bij een bredere populatie patiënten met Parkinson.
“We kunnen niet enthousiast genoeg zijn over deze mogelijkheid om mensen te helpen, die lijden aan deze genetische vorm van de ziekte van Parkinson, maar de lessen die uit dit onderzoek worden geleerd zullen ook rechtstreeks van invloed zijn op patiënten die lijden aan sporadische, of niet-genetische vormen van deze ziekte”, aldus het persbericht van de universiteit. Het oorsronkelijke onderzoek werd gepubliceerd in het tijdschrift Nature Regenerative Medicine en is getiteld: “Optimizing maturity and dose of iPSC-derived dopamine progenitor celltherapy for Parkinson’s disease.”
Fig. 1: De zwarte cellen van de Substantia Nigra zijn hier goed te zien. Vlak daarboven ligt de nucleus subthalamicus, de plaats waar de neurochirurg bij Deep Brain Stimulation (DBS) de electrode plaatst en van waaruit de electrische stimulatie plaats vindt. Bij patiënten met de ziekte van Parkinson veroorzaakt het afsterven van cellen in de substantia nigra symptomen, zoals tremor en problemen met lopen en balanceren. Om het tekort aan dopamine producerende neuronen aan te vullen, hopen de onderzoekers door middel van deze neiuwe aanpak weer nieuwe dopamine producerende cellen in de substantia nigra te kunnen aanmaken.
Bron afbeelding: Wikimedia Commons
Om nieuwe stamcellen te produceren gebruikten de onderzoekers pluripotente stamcellen (iPSC’s), een type cel dat zich kan ontwikkelen tot elk ander type cel in het lichaam. Er zijn twee belangrijke stappen nodig om iPSC’s te maken. In de eerste stap worden volwassen bloedcellen behandeld met een “cocktail” van herprogrammeringsfactoren die ervoor zorgen dat ze terugkeren naar een embryonale staat. In de tweede stap worden ze behandeld met extra factoren die ervoor zorgen dat ze veranderen in het gewenste type cel – de dopamine producerende neuronen. In de studie ontdekten de onderzoekers dat als ze slechts 17 dagen wachtten – in plaats van langer, 24 of 37 dagen – voordat ze de tweede stap invoerden, de neuronen beter gedijden wanneer ze in de hersenen van ratten werden overgebracht. De onderzoekers noemden deze neuron “progenitors” omdat ze in het laboratorium nog niet volledig waren gerijpt. Ze innerveerden (voorzagen van zenuwtakken) ook over langere afstanden naar andere gebieden van de hersenen, waaronder het striatum, zoals bleek uit het genereren van meer dopamine producerende zenuwcelprojecties. Veel van de dopamineproducerende neuronen moeten van een gezond substantia nigra projecteren naar het striatum. “Dat is belangrijk, want ze moeten over lange afstanden groeien in het grotere menselijke brein, en we weten nu dat deze cellen daartoe in staat zijn”, aldus de leider van het onderzoeksteam.
Afbeelding: Wikimedia Commons.
Om te zien hoe goed de in het laboratorium gemaakte neuronen werkten om de verloren motorische functie te herstellen, gingen de onderzoekers aan de slag met een model van parkinsonisme bij ratten.
In het model wordt parkinsonisme slechts aan één kant van het lichaam geïnduceerd door injectie van 6-hydroxydopamine – een stof die giftig is voor dopamine producerende neuronen. Wanneer ratten worden gestimuleerd met een amfetamine, draaien ze rondjes. De ratten met parkinsonisme draaiden meestal slechts in één richting, wat wijst op een verlies van de motorische functie. Wanneer de ratten echter werden geïnjecteerd met progenitors (dat zijn voorlopercellen) van neuronen, draaiden ze in beide richtingen. Deze bevinding toonde aan dat de in het laboratorium gemaakte neuronen in staat waren de verloren motorische functie te herstellen.
Om te begrijpen of meer geïnjecteerde cellen betere resultaten kunnen opleveren, testte het team een breed dosisbereik, van 7.500 tot 450.000 cellen per striatum. Zij ontdekten dat hogere doses resulteerden in betere overleving en innervatie en een sneller en vollediger functioneel herstel opleverden dan lagere doses. “Er was een duidelijke dosisrespons met betrekking tot het aantal overlevende neuronen, innervatie en functioneel herstel,” schreven de onderzoekers.
Innervatie was echter het best gecorreleerd met functioneel herstel bij lagere doses. “Dit suggereert dat een relatief klein totaal aantal cellen nodig zou kunnen zijn om te worden geïnjecteerd op een klein aantal locaties in het striatum in elke patiënt, wat gunstig is vanuit een klinisch veiligheidsstandpunt,” schreven de onderzoekers. “De vroege dosisescalatiestudies bij mensen zullen informatie opleveren voor toekomstige centrale proeven.”
De klinische proef wordt ondersteund door een subsidie van de Michael J. Fox Foundation for Parkinson’s Research en zal op een aantal locaties worden uitgevoerd, waaronder het Barrow Neurological Institute in Phoenix. Het zal worden gecoördineerd door Jeffrey Kordower, PhD, de professor aan de Arizona State University die ook het onderzoek bij ratten leidde.