De zoveelste mislukking van een potentieel nieuwe geneesmiddelen tegen de ziekte van Alzheimer.
Bron: “Science” maart 2019.
“Futiel”– dat is het rampzalige label dat nu is geplakt op het effect van twee langverwachte klinische onderzoeken naar een medicijn dat gericht is op β-amyloïde, het neuronen afbrekende eiwitfragment dat de hersenen van mensen met de ziekte van Alzheimer aantast.
De firma’s Biogen in Cambridge, Massachusetts en Eisai in Tokio, twee farmaceutische partners, die het medicijn aducanumab genaamd, ontwikkelen, hebben vandaag hun besluit aangekondigd om een paar lopende fase III-onderzoeken stop te zetten. Dit nadat ze deuitkomst van een “futiliteitsanalyse” hebben gezien. Een onafhankelijk comité bepaalde dat het onwaarschijnlijk is dat het medicijn de cognitieve achteruitgang zou vertragen, zoals wel was verwacht.
Na deze nieuwste tegenslag tegen het β-amyloïde eiwit, vragen de onderzoekers zich af of het wel zin heeft om door te gaan met de resterende anti-amyloïd geneesmiddelen, die nog in de pijplijn zitten, of wordt het tijd om de hele aanpak als zinloos te verklaren?
“Het fnuikende label dat op de werkzaamheid wordt geplakt is: “Futiel”.
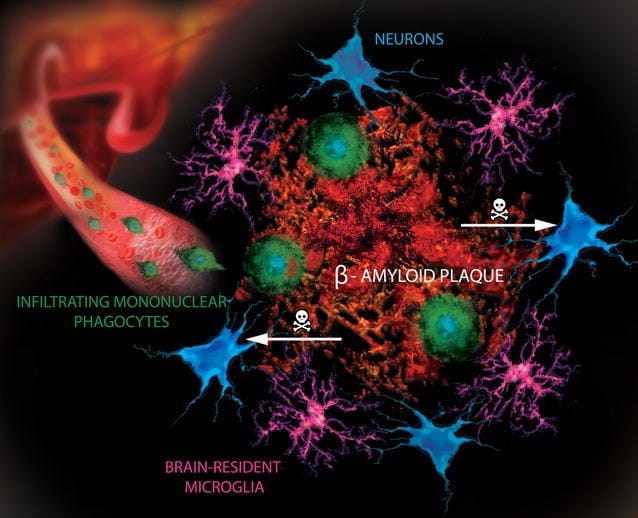
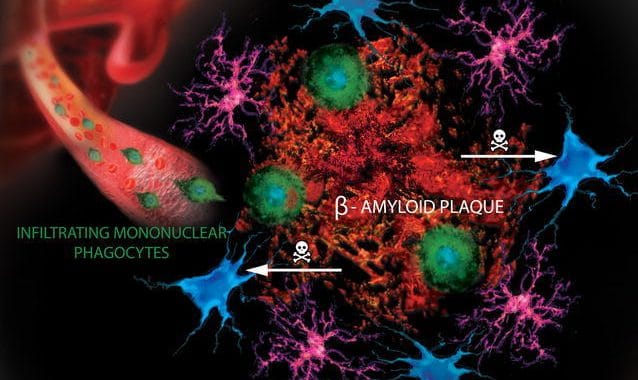
Aducanumab is een antilichaam dat is ontworpen om zich te binden aan de kleverige β-amyloïde plaques en deze vervolgens te elimineren. De β-amyloïde plaques hopen zich op rond neuronen, die daardoor niet meer kunnen communiceren en uiteindelijk afsterven. Uit een kleinere klinische studie had men het idee gekregen dat dit medicijn zeer effectief was in het verwijderen van plaques – “dat is een van de redenen waarom we optimistisch waren over deze proef.” Dat zegt neuroloog Dennis Selkoe van Brigham en het Women’s Hospital in Boston, die patiënten behandelt die waren ingeschreven bij een van de proeven. Eerdere kleinschalige onderzoeken suggereerden ook dat aducanumab de meest schadelijke vorm van amyloïd- de zogenaamde oligomeren- kan aanvallen, die door andere geneesmiddelen mogelijk onaangeroerd zijn gebleven. In de studies, onder de naam EMERGE en ENGAGE, waren mensen geïncludeerd met zowel cognitieve stoornissen als bevestigde amyloïde plaques in hun hersenen.
Volgens schattingen had 20% tot 30% van de patiënten in eerdere onderzoeken met anti-amyloïde geneesmiddelen geen significante amyloïde-opbouw, zeggen de onderzoekers, wat hun falen zou kunnen verklaren.
Maar die voordelen konden aducanumab niet drijvend houden. In het persbericht wordt geen gewag gemaakt over wat er misging in de proeven. Ze merken wel op dat het besluit van deze maand niet gebaseerd was op veiligheidsrisico’s. Hoewel de trials mensen met milde, vroege vormen van Alzheimer rekruteerden, is het mogelijk dat de ziekte al te ver gevorderd was om de amyloïde plaques door aducanumab te laten oplossen, zegt Selkoe.

Als dat het geval is, dan zullen de meest succesvolle onderzoeken moeten worden gehouden met mensen die nog geen klinische symptomen hebben, maar een verhoogd risico hebben op het ontwikkelen van dementie.
De anti-Amyloïde behandeling in ‘Asymptomatic Alzheimer’s studie’, die in 2020 afgerond moet zijn, is het testen van het antilichaam solanezumab (dat faalde in een eerdere proef, die werd gesponsord door Eli Lilly) bij mensen die amyloïde-opbouw in hersenscans vertonen, maar nog geen tekenen van geheugenverlies hebben.
In de Dominantly Inherited Alzheimer Network trial hebben bedrijven en academische centra samengewerkt om solanezumab en een ander amyloïd-gericht antilichaam te testen bij mensen met een door de ziekte van Alzheimer veroorzaakte erfelijke mutatie, maar zonder symptomen.
Een andere mislukte kandidaat-medicijn, crenezumab, is ook nieuw leven ingeblazen in een studie gericht op mensen met een Alzheimer-mutatie die zich nog in de “preklinische” fase van de ziekte bevinden.

Het onderzoek naar medicijnen gericht op het afbreken van het eiwit Tau.
Ondertussen vinden andere, non-amyloïde benaderingen hun weg door klinische testen, waaronder medicijnen die zich richten op het eiwit-tau dat zich opbouwt in de neuronen van de hersenen van Alzheimer. “Het is van cruciaal belang, dat we, zolang we moeten wachten op de resultaten van de [aducanumab] studie, dat we actief en in het algemeen meerdere kandidaat-doelen moeten blijven nastreven”, zegt Richard Hodes, directeur van het National Institute on Aging in Bethesda, Maryland.,
Selkoe is van plan om enkele van zijn patiënten met proeven mee te laten doen van de antitau-aanpak, zodra aducanumab uit hun bloed is verdwenen. Maar hij is nog niet bereid om anti-amyloïde behandelingen op te geven voor patiënten met milde symptomen – net zo min als enkele farmaceutische ondernemingen.
De Zwitserse medicijnen fabrikant Roche blijft het antilichaam gantenerumab testen, ook nadat het in proeven met een lagere dosis is mislukt.
Biogen en Eisai blijven samenwerken aan twee andere anti-amyloïde geneesmiddelen. Een daarvan is BAN2401, een antilichaam dat zijn primaire eindpunt in een fase II-studie niet heeft gehaald, maar mogelijk toch potentie heeft, beweren de bedrijven. De andere is elenbecestat, een molecuul dat de productie van amyloïden blokkeert.
De bedrijven hebben nog niet gezegd of de resultaten van de studie met aducanumab hun plannen voor het testen van deze andere twee geneesmiddelen veranderen. (Op 22 maart kondigde Eisai aan dat het een fase III-studie van BAN2401 startte met 1566 patiënten met milde vormen van Alzheimer.)
“We moeten doorgaan met alle mogelijke kandidaat-medicijnen, die in de pijplijn zitten”, zegt Snyder over de anti-amyloïde medicijnen die nog in onderzoek zijn. “Ze zitten in de pijplijn omdat de wetenschap ze heeft voorgesteld.”